Zolgensma
Zolgensma (onasemnogene abeparvovec-xioi), comercializado pela Novartis Gene Therapies, é um tratamento aprovado pela ANVISA para a AME. É um tipo de tratamento denominado terapia gênica ou terapia de substituição gênica.
O Zolgensma obteve o registro na Anvisa para o tratamento de pacientes pediátricos diagnosticados com AME do tipo 1, com até 2 anos de idade, com mutações bialélicas no gene de SMN1 ou até três cópias de outro gene conhecido como SMN2.
O Zolgensma é administrado por perfusão intravenosa (IV) que demora cerca de uma hora. É um tratamento único.
Zolgensma é uma terapia de reforço de SMN que funciona substituindo a função do gene SMN1 ausente ou não funcional por uma nova cópia funcional de um gene SMN. Um vírus, AAV9, carrega o gene de substituição para o corpo. Este vírus “infecta” as células com o novo DNA.
Como acontece com todos os tratamentos, o tempo é crítico. Os bebês dosados com Zolgensma assim que possível após o diagnóstico tiveram melhores resultados do que aqueles que esperaram para começar o tratamento.
Terapia gênica intratecal (IT)
A dosagem IV de terapia genética só pode ser administrada a bebês com um certo limite de peso 21 kgs. Novartis Gene Therapies está testando atualmente uma segunda forma de administração de terapia genética. Isso ocorre por meio de uma injeção intratecal (IT), que é uma injeção diretamente no líquido cefalorraquidiano através da parte inferior das costas. Esse método de aplicação poderia eventualmente tornar esse tratamento disponível para pacientes mais velhos e maiores. Atualmente, este método de entrega está sendo estudado em um ensaio clínico de Fase 1 em crianças de até cinco anos de idade com AME tipo 2 nos Estados Unidos. Se os resultados forem positivos, a Novartis Gene Therapies pode solicitar a aprovação do FDA(ANVISA americana) para este método assim que os resultados comprovarem a eficácia e segurança do tratamento.
No momento o único meio de acesso ao tratamento no país é via judicial, pois o medicamento é aprovado pela ANVISA, mas até o momento não foi submetido à CONITEC para incorporação ao SUS, porque a fabricante contesta o valor de registro no Brasil, por volta de R$ 2,8 milhões de reais.
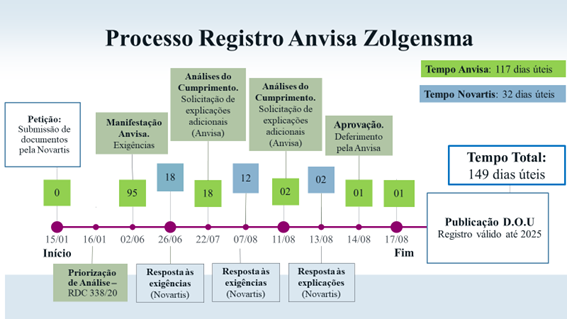
Link da publicação no DOU (Diário Oficial da União)
https://www.in.gov.br/web/dou/-/resolucao-re-n-3.061-de-14-de-agosto-de-2020-272511373
Risdiplam
Evrysdi (risdiplam), comercializado pela Genentech, um membro do Grupo Roche, é uma terapia aprovada pela Anvisa para tratar a AME. É uma terapia intensificadora de SMN que atua visando o gene SMN2. É uma pequena molécula que faz com que esse gene produza uma proteína SMN mais completa.
Evrysdi foi aprovado pela ANVISA para o tratamento de AME em adultos e crianças com 2 meses ou mais e sem restrição de idade, portanto uma aprovação ampla inclusive sem especificação de tipo.
Evrysdi foi testado em vários grupos diferentes, de bebês a adultos. Também está sendo estudado em indivíduos que receberam anteriormente uma terapia de intensificação de SMN diferente. Os indivíduos neste estudo devem primeiro passar por um período de “washout” – isto é, eles devem parar de tomar o medicamento anterior e esperar que ele deixe o corpo – antes de se inscreverem.
Evrysdi é um medicamento oral diário e deve ser tomado durante toda a vida do indivíduo.
Link de aprovação na ANVISA (https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2020/registrado-novo-medicamento-para-tratamento-de-ame)
Link de publicação no DOU (Diário Oficial da União)(https://www.in.gov.br/en/web/dou/-/resolucao-re-n-4.079-de-8-de-outubro-de-2020-282194844)
História de Evrysdi
Evrysdi é um medicamento oral com distribuição sistêmica e projetado para aumentar os níveis de proteína SMN no sistema nervoso central (SNC) e em todo o corpo. Ele é projetado para ajudar o gene SMN2 a produzir proteína SMN mais funcional, que suporta melhor os neurônios motores e a função muscular. Roche e Genentech lideraram o desenvolvimento clínico de Evrysdi em colaboração com The SMA Foundation(EUA) e PTC Therapeutics(EUA). A aprovação de Evrysdi foi baseada em quatro ensaios clínicos multicêntricos em pessoas com AME que ocorreu inclusive no Brasil e algumas das crianças participantes nossa associação teve a grata oportunidade de encaminhar para participar dos ensaios clínicos no hospital das Clínicas de São Paulo.
Aprovado pela ANVISA o medicamento foi submetido à CONITEC, para incorporação ao SUS no final do mês de maio de 2021, mas enquanto a incorporação não acontece o único meio de acesso ao tratamento é judicialmente.
Spinraza
Spinraza (nusinersen), comercializado pela Biogen, foi a primeira terapia aprovada no mundo para tratar AME em dezembro de 2016 nos EUA e consequentemente em agosto de 2017 pela Anvisa no Brasil e atualmente conta com dezenas de aprovações em diversos países. É uma terapia intensificadora de SMN que atua alvejando o gene SMN2 , fazendo com que ele produza uma proteína mais completa.
Spinraza obteve uma aprovação ampla pela ANVISA para portadores de AME com cromossomo 5q, sem restrições por idade ou tipo, sua bula aprovada recomenda o tratamento para os tipos 1, 2, 3 e deixa a critério do médico prescrever para os tipos 0 e 4.
Spinraza é administrado através de uma injeção intratecal (IT), que é uma injeção diretamente no líquido cefalorraquidiano através da parte inferior das costas. Os indivíduos recebem quatro “doses de carga” nos primeiros 2 meses de tratamento. Uma vez que essas doses de carga são concluídas, eles recebem uma dose de manutenção a cada 4 meses durante a vida do indivíduo.
Spinraza é um oligonucleotídeo antisense. Drogas antisense são pequenos fragmentos de material genético sintético que se ligam ao ácido ribonucleico (RNA), de modo que podem ser usados para corrigir erros de splicing em genes como SMN2.
Como acontece com todos os tratamentos, o tempo é crítico. Os indivíduos que iniciaram o Spinraza assim que possível após o diagnóstico tiveram melhores resultados do que aqueles que esperaram para iniciar o tratamento.
História de Spinraza
De 2003 a 2006, a Cure SMA americana forneceu o primeiro financiamento de pesquisa necessário para iniciar a investigação desta abordagem terapêutica. Gostaríamos de agradecer e reconhecer o Cold Spring Harbor Laboratory (CSHL) e a University of Massachusetts Medical School por gerar propriedade intelectual crítica para o programa que foi licenciado para a Ionis Pharmaceuticals.
Agradecimentos especificamente aos drs. Adrian Krainer, Yimin Hua e colegas da CSHL por anos de dedicação e trabalho árduo no desenvolvimento pré-clínico de Spinraza para AME, bem como os Drs. Ravindra Singh e Elliot Androphy por seu trabalho, financiado pela Cure SMA, na identificação original da sequência do gene ISSN1, que é a sequência alvo em Spinraza.
Depois que o trabalho pré-clínico e os primeiros testes clínicos foram concluídos, a Ionis Pharmaceuticals fez uma parceria com a Biogen para lançar uma série de ensaios clínicos testando o Spinraza.

Spinraza no Brasil
Spinraza foi a aprovado pela Anvisa em 28 de agosto de 2017 sendo a aprovação mais rápida da história da agência para um medicamento de alto custo para comercialização no pais. Depois de uma longa campanha e muitas viagens a Brasília conseguimos incorporar o tratamento ao SUS em 24 de abril de 2019 em cerimônia no Senado Federal em Brasília com a participação do nosso Guerreiro Gianlucca, após uma longa viagem de carro que durou mais de 17 horas, infelizmente o protocolo de tratamento, o PCDT(segue acesso ao protocolo abaixo do texto), impõe critérios de exclusão que são fora da realidade em dezenas de países e também na própria bula do medicamento, seguimos na luta pela disponibilização do tratamento para todos e para os pacientes excluídos de ter acesso ao tratamento pelo SUS, é possível solicitar o medicamento junto aos planos de saúde pois a ANS recomenda o seu fornecimento por ser de uso hospitalar e caso não seja cumprido pela operadoras pode se abrir uma reclamação junto a ANS para tentar resolver a situação ou mesmo acionar a justiça que também pode ser o caminho para o paciente que irá requerem o tratamento por meio do poder público.
PCDT link para acesso:
Despacho da Agência Nacional de Saúde Suplementar(ANS), sobre a obrigatoriedade de fornecimento de Spinraza pelo planos de saúde.
